本帖最后由 国正行 于 2021-5-8 09:30 编辑
核心提要:
1. 2021年5月7日,世卫组织将中国国药新冠疫苗列入“紧急使用清单”。这是中国生产的第一种获得世卫组织紧急使用授权的疫苗,也是非西方国家首个获得世卫组织支持的新冠疫苗。对中国的疫苗企业来说,这是一个里程碑事件。科兴疫苗预计也将很快得到批准。
2 . 此前世卫的新冠疫苗紧急使用名单,只批准了5种疫苗: 辉瑞、牛津大学腺病毒载体疫苗(分别由阿斯利康、 印度血清研究所生产)、强生、莫德纳。
3.世卫组织于4月29日和5月3日分别评估了国药北生所和科兴的灭活疫苗。由于在临床试验中,老年人和并发疾病人群样本较少,因此世卫认为证据质量不足。与其他疫苗相比,科兴疫苗的总体评估不如莫德纳和强生,但是好于牛津大学的阿斯利康疫苗。
4. 疫苗对成年人保护的有效性和安全性是最主要的评估指标,国药和科兴疫苗在该方面的评分与其他已批准的疫苗相同,再加上全球疫情态势对疫苗的高需求量。即使国药疫苗的部分评分较低,也仍然会被世卫批准紧急使用。
2021年5月7日,世卫组织总干事谭德塞宣布,将中国国药集团中国生物北京生物制品研究所研发的新冠疫苗列入“紧急使用清单”。科兴疫苗预计也将很快得到批准。
这是中国生产的第一种获得世卫组织紧急使用授权的新冠疫苗,也是非西方国家首个获得世卫组织支持的疫苗。批准将向世界各国发出信号,表明中国国药疫苗可以安全使用,并且可以将国药新冠疫苗添加到世界卫生组织的疫苗采购计划COVAX中。
世界卫生组织于4月29日和5月3日分别评估了国药北生所和科兴的灭活疫苗。对于两款疫苗预防成年人感染病毒的有效率,世卫认为证据高度可信;对于接种疫苗后不良事件的风险,世卫也认为证据可信度中等。对于老年人和有并发疾病的人群,世卫认为科兴疫苗有效率的证据质量中等,但安全性证据不足。对于国药疫苗,由于在临床试验中,老年人和并发疾病人群样本较少,世卫认为证据质量不足,在某些方面甚至非常低。国内媒体与学者也是第一次看到世卫发布的科兴、国药的三期临床试验的数据。关于这两款国产灭活疫苗在老年人与并发疾病人群中,所谓的保护力与安全性证据较低的说法,显然引发了巨大的争议与关切。
据了解,有专家在对比了世卫公布的辉瑞、莫多那、强生与阿斯利康疫苗的数据之后,表示国内这两款灭活疫苗的数据虽然仍需再度收集,但仍比阿斯利康疫苗的数据要好。世卫紧急宣布授予国药北生所疫苗以“紧急使用清单”,属于有条件批准,也是预期中的事。
01 谁替世卫评估疫苗数据?评估什么内容?他们是如何评估国药与科兴疫苗的,依据是什么?
对疫苗数据进行评估的,是世卫的免疫战略咨询专家组(The Strategic Advisory Group of Experts on Immunization),简称SAGE。世界卫生组织的这个机构,负责就疫苗技术、研发、免疫接种以及其他与卫生干预措施有关的问题,给世卫提供建议。对于疫苗的临床数据,SAGE工作组所考察的主要是关于以下4问题:
1)在成人(18-59岁)中疫苗有效性和安全性的证据是什么?
2)在老年人群中使用的证据是什么?
3)对于有基础疾病的人,疫苗的有效性和安全性的证据是什么?
4)证据的可信度如何?
可以看出来,这些问题主要是涉及三个人群(18-59岁成人、60岁以上年纪较大的人、有基础疾病的人),就疫苗的有效性和安全性数据进行评估,并没有横向比较不同疫苗的有效率和安全性。
4月29日和5月3日,SAGE工作组分别对国药北生所和科兴的灭活新冠疫苗进行了评估,评估结果如下: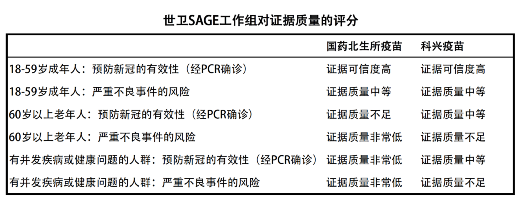
综合一下评估报告, 世卫认为两款疫苗预防成年人感染病毒的有效率证据高度可信,安全性数据的证据可信中等。对于老年人和有并发疾病的人群,世卫认为两款疫苗的安全性证据质量非常低(国药疫苗)或者不足(科兴疫苗)。
国药有两款灭活疫苗,一款是北生所,一款是武汉所。世卫目前所评估的,是国药北生所疫苗(BBIBP-CorV)。该疫苗于2020年12月31日获中国药监局附条件批准,目前已经在45个国家或地区获批,适用于18岁以上成人,紧急使用接种的剂量达到了6500万剂。
而科兴疫苗目前同样已经在32个国家或地区获批,适用于18岁以上成人,而且接种剂量已经达到2.6亿剂。这样两款已经大规模使用的疫苗,为什么世卫还有不满意的地方,对于某些方面的评估居然是“证据质量非常低”?我们来看一下具体内容。
02 国药疫苗首次公开临床数据,到底什么地方让世卫不满意?
国药的疫苗一直没有公开过数据,只是在媒体宣传过“疫苗针对由新冠病毒感染的疾病的保护效力为79.34%”。因为世卫的审批,国药北生所疫苗的临床试验数据第一次曝光。
从这个在阿联酋、巴林、埃及、约旦等国家进行的3期临床试验结果上看,疫苗对病毒感染所致疾病的保护效力确实有78.1%,与之前新闻报道的数字相近。 但是,对预防住院的有效率,只有78.7%,而对于防止重症的有效率,因为病例数太少(安慰剂组2例,疫苗组0例),无法评估。之前新闻中提到“100%预防重症”,是对这2例和0例病例数最简单粗暴的解读,并不具有科学性。 对于老年人(年龄为60岁以上者),临床试验中共有415人,其中209人接种疫苗,206人属于安慰剂组,因为这415人中没有一例新冠病例,自然也无法评估有效性。根据这样的数据,世卫SAGE工作组给出了“证据质量不足”的评估,也是很合理的。 吃瓜群众如果对此难以理解,可能是习惯了媒体简单粗暴的解读。同样一个数据,有的媒体可以表达为“接种疫苗者无一感染”,但那并不是一个科学的评估。这真是没有比较,就没有伤害。 当然。为了弥补临床实验数据的不足,国药也提供了在巴林上市后的统计数据。数据显示,在60岁以上的人中,注射疫苗的有303人,其中65人感染,而没有注射疫苗的438人中,有328人感染,所计算出来的疫苗有效率为91%(注:所引用的有效率来自原表格,不知如何计算而来)。 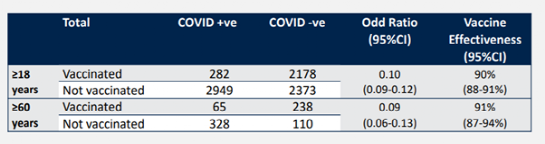
不管有效率是多少,巴林的这个数据,只是一个回顾性调查的数据,并不是正规的干预性临床试验,因此证据的含金量不够,SAGE的结论为“证据质量不足”,也是合理的。 关于老年人中的安全性数据,因为临床试验中相关人数太少,自然无法获得任何结论。国药所提供的,是中国60岁以上老年人接种110万剂疫苗之后的调查,收到的不良反应报告有79例,其中45例被认为与疫苗相关。 有这样一个数据,为什么SAGE还是认为“证据质量非常低”?SAGE没有给出具体的答案,但应该是对不良反应追踪系统的完整性有所怀疑。 比如说,同样是紧急使用之后的安全性数据,成年人接种的总数为590万剂,出现了1453例不良反应报告。这些不良反应不管是否与疫苗有关,大多比较轻微,每百万人中不良反应报告率为246例;相比之下,在老年人中,每百万人中不良反应报告率却只有72例,不及总人群不良反应率的三分之一。 对此,SAGE应该是难于理解的。很显然,这不可简单理解为该疫苗对老年人更安全。 对于有并发疾病的人群,所存在的问题也同样是临床试验中入组人数太少。 除了肥胖症者各有3000名志愿者接种疫苗或安慰剂,高血压、糖尿病的人数太少,无法做出可靠的分析。 此外,在国药的临床试验中,女性志愿者的比例也很少,只占15%左右,这对有效率数据的可信度也有所影响。
03接种2.6亿剂,科兴疫苗数据大梳理,为何世卫认为科兴的数据可靠? 科兴疫苗的数据之前已经公开报道过,总体上看,SAGE工作组对科兴疫苗的评价更高一些,除了认为60岁以上老年人和有并非疾病、健康问题人群的安全性问题证据不足,疫苗对各种人群的有效性,都没有问题。 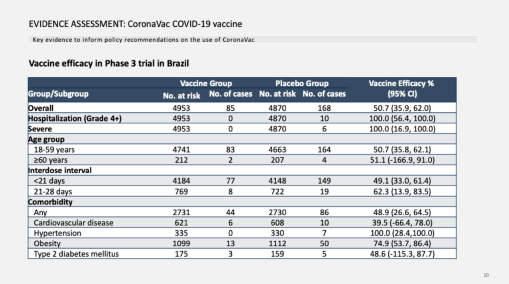
先说有效性问题,科兴疫苗同时在巴西、土耳其、印尼等地进行3期临床试验,由于各地流行的病毒株有所不同、年龄的组成不同,疫苗的保护率也有所不同。 最主要的数据来自巴西临床试验,疫苗整体有效力为50.7%,疫苗组85例感染,安慰剂组168例感染;预防住院的有效力为100%,疫苗组0例住院,安慰剂组10例住院;预防重症有效力为100%,疫苗组0例,安慰剂组6例。 需要指出的,对于预防住院的有效率,虽然计算出来的是100%,但是因为对照组出现的病例数较少,只有6~10例,所以不见得真的能达到这么完美的保护。从具体数据上看,预防住院有效力的可信范围是56.4% ~100%,预防重症有效力的可信范围是16.9% ~100%。(注:国外的其他疫苗,在临床数据中也有这个问题,都需要谨慎解读。) 相比之下,世卫觉得科兴疫苗证据可信度更高,是因为有关老年人和并发疾病者的数据较为完整。对于60岁以上的老年人,疫苗组发生2例感染,安慰剂组有4例,所计算出来的有效保护率为51.1%;对于有并发疾病者的志愿者,整体有效力是48.9%,其中对于心血管疾病、高血压 、肥胖症、 2型糖尿病者的保护率分别为39.5%,100%,74.9%,48.6%。 同样需要指出的是,除了肥胖症,其他并发疾病人群的发病数并不多,所以保护率的可信范围比较大,也只能作为参考。 基于这些数据,世卫给出了“证据质量中等”的评估,也是非常合理的。 对于目前大家比较关心的病毒变异株的防护效率,科兴也提供了临床试验及上市后的调查数据。 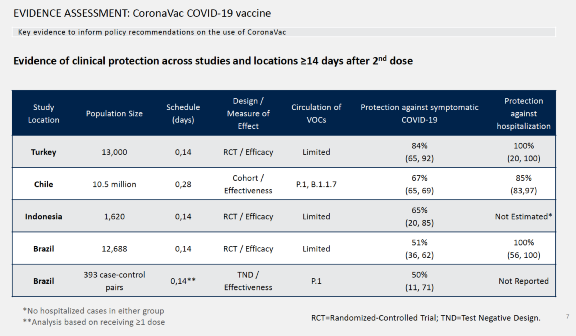
在土耳其的临床试验中,基本无变异毒株,科兴疫苗预防有症状的效力为84%,预防住院效力为100%。 在智利的上市后调查数据中,有巴西突变毒株(P.1)、英国突变毒株(B.1.1.7),科兴疫苗预防有症状的效力为67%,预防住院效力为85%。在巴西的上市后调查数据中,有巴西突变毒株(P.1), 疫苗预防有症状的效力为50%。突变株可能会对疫苗的保护效果有所影响,但是疫苗并未失效。 关于安全性,世卫认为科兴疫苗“严重不良事件风险较低”这个结论的证据质量中等,有一定信心认为安全性良好,接种疫苗后发生严重不良事件风险较低。 在临床试验中,最常见的不良事件是注射部位疼痛、头痛、疲劳和肌痛,不良事件多为轻度/中度,整体上安全。 在授权上市后,对安全性数据监测结果如下: 中国:根据已经分发的3580万剂疫苗所收到的报告,有49例严重不良事件,包括严重过敏反应、过敏性紫癜、喉水肿、脱髓鞘、脑出血(n≤6); 巴西/印度尼西亚:根据已分发的约1700万剂疫苗所收到的报告,有162例严重不良事件,包括发烧,呼吸困难、死亡、头痛(n≤16) 智利:根据分发的370万剂疫苗所收到的报告,有90起严重不良事件。最常见的是严重过敏反应的临床症状,报告率为每10万剂疫苗接种有1.7例,低于另一种新冠疫苗的报告率。
04两款灭活疫苗评分并不完美,甚至某些方面“证据质量非常低”,但这两款疫苗的数据均好于阿斯利康疫苗,世卫会不会批准? 应该说,SAGE的评估,还是比较客观的评估,是基于国药和科兴提供的客观数据。 这也是SAGE对各款疫苗的评估,都是这样操作。 对其他疫苗,世卫也不是每一项都给出“证据可信度高”的评估。相比之下,科兴疫苗的总体评估不如莫德纳和强生,但是好于牛津大学的阿斯利康疫苗。 有了SAGE专家组的评估,世卫应该在一个星期内做出是否批准这两款疫苗的决定。 有人看了世卫的评分,觉得很失望,尤其是国药疫苗的部分评分为“证据质量非常低”,感觉过不了关。 那么此次国药疫苗过关的依据是什么呢? 第一,最主要的评估是疫苗对成年人保护的有效性和安全性的评估,两款疫苗的证据都为证据可信度高、质量中等,这个评分与其他已批准的疫苗相同。 会不会把国药疫苗的接种人群限制于18~60岁呢? 有这种可能性,但是可能性并不 大。 如果要较真,没有哪一款疫苗在非洲进行过临床试验,也就没有证据表明疫苗在非洲也会有效,是不是也应该限制疫苗在非洲的使用呢? 对于老年人和有并发疾病的人群,国药疫苗“证据质量非常低”,这并不等同于安全性就存在严重问题。 到底有没有问题,可以在实际使用过程中收集数据。 所以,世卫不但会批准两款疫苗,而且也不会限制使用人群。 第二个依据, 世卫批准疫苗并不是为了政治表态,而是确确实实需要疫苗来拯救很多国家的疫情。 此前,世卫的新冠疫苗紧急使用名单,只批准了5种疫苗: 辉瑞、牛津大学腺病毒载体疫苗(分别由阿斯利康、 印度血清研究所生产)、强生、莫德纳。 世卫通过COVAX机制,计划今年采购20亿剂新冠疫苗,其中一半会提供给发展中国家使用。 按照进度,到5月底前,COVAX应该收到4000万剂疫苗,但是目前实际采购到的疫苗数量还不到四分之一。 印度血清研究所是COVAX的主要货源,今年应该供应10亿剂,但受到印度疫情海啸的影响,印度自身难保,未来几个月之内COVAX能收到疫苗的可能性趋近于零。 强生同意在2021年给COVAX提供2亿剂疫苗; 在今年一月,辉瑞德国BioNTech与COVAX签订了合同,在今年提供4000万剂疫苗; 5月3日,莫德纳同意在今年提供3500万剂疫苗; 即便这些疫苗能如期提供,也远远不能满足COVAX的需求。 所以,对于两款中国疫苗,世卫的评估是实事求是的,需求是实实在在的。 5月4日,欧盟表示将开始对科兴的疫苗进行滚动式审批。除了莫德纳公司,欧盟、世卫所批准的新冠疫苗,都来自辉瑞、强生、阿斯利康等国际巨型药企。如果能获得欧盟和世卫的批准,这对中国的疫苗企业来说,将是一个里程碑事件。(凤凰肿瘤情报局 张洪涛/宾夕法尼亚大学医学院副教授 ) |